ミッドカイン HOME > ミッドカインについて
がんとミッドカイン
ヒトがんの多くでミッドカインの発現は増大している。食道がん、胃がん、大腸がん、肝臓がん、膵臓がん、甲状腺がん、肺がん、乳がん、膀胱がん、子宮がん、卵巣がん、前立腺がん、ニューロブラストーマ、グリオブラストーマといった多様ながんでこの現象が起こる。それぞれのがんで症例ごとに比べると、約 80%のケースでこの発現増大が起こっている(図2)。
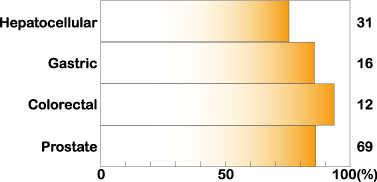
図2
ヒト癌におけるミッドカインの発生上昇。非癌部に比較して上昇しているケースをパーセント表示した。Muramatsu, T., J. Biochem. 132, 359-371 (2002) より引用。
WT1がん抑制遺伝子の欠失によって起こるウィルムス腫瘍、NF-1がん抑制遺伝子の欠失に起因する神経系の腫瘍の全症例でミッドカインの発現増大が起こることも注目すべきである。ニューロブラストーマ、膀胱がん、グリオブラストーマなどではミッドカインの発現が強いがんを持つ患者は弱い発現のがんを持つ患者より予後が悪いことも分かっている。さらに、ヒト胃がんの細胞株では抗がん剤抵抗性とミッドカインの強発現の間に強い関連がある。
がん患者の血清中のミッドカイン値も多くのケースで増大し、ミッドカインを腫瘍マーカーとして用いることが計画されている。ミッドカイン値はしばしば初期がんの患者でも上昇するし、予後の悪いがんの患者で比較的高いので、マーカーとしての有用性が大きいと期待される。
ミッドカインはがん細胞の生存と移動を促進し、血管新生を促し、がんの進展を助けると考えられている。ミッドカインの生産を抑えるアンチセンスオリゴDNAやsiRNAはヌードマウスで生育したがんの増殖を抑える。そこで、ミッドカインを標的としたがん治療が計画されている。さらに、ミッドカインのがん選択的発現に立脚して、ミッドカイン遺伝子上流のプロモーター領域を使って、癌細胞に特異的に有害な遺伝子を発現させることも可能である。マウスを使った実験はすでに成功している。
炎症性疾患とミッドカイン
ミッドカインは炎症像形成の過程で中核を占める分子の一つである。例えば、血管に傷害を与えた時の新生内膜の形成と虚血傷害時の腎炎の発症が、ミッドカイン遺伝子を欠失させたノックアウトマウスでは軽減されているのである。また、リュウマチ・モデル、多発性硬化症モデル、手術後の癒着もノックアウトマウスで大きく軽減される。
ミッドカインはマクロファージや好中球といった炎症性細胞の移動を促進する。この移動は炎症像の成立に必要なので、ミッドカインが欠失すると炎症に基盤がある病気が起こりにくいと考えられる。さらにミッドカインは調節性T細胞の働きを抑える。ミッドカインを分子標的としてこれらの疾病を予防、治療する計画が進んでいる。
細胞死を防ぐミッドカイン
ミッドカインにはアポトーシスによる細胞死を防ぐ作用があり、ことに胎児の神経細胞の生存維持作用が著しい。ラットの目に連続光照射すると網膜の神経細胞が死減する。この時、あらかじめ網膜下にミッドカインを注入しておくと神経細胞死を防止できる。砂ネズミの脳への血流を防げて、その後、血行を再開すると虚血性のショックを受け、やがて海馬の神経細胞が死滅し、脱落してゆく。この時、あらかじめ脳室内にミッドカインを注入しておくと、この細胞死の進行を遅らせることができる。さらに、ミッドカインは虚血後の心筋細胞死を防止する働きを持つことが発見された。心筋梗塞後の心不全の防止への応用が期待される。
ミッドカインはアルツハイマー病患者の老人斑に強く沈着している。ミッドカインはアミロイドb-ペプチドと結合して、その細胞傷害活性を抑えることも見出された。ミッドカインはアルツハイマー病の進行を抑えるために傷害を受けた脳で生産されている可能性がある。
ミッドカインは体外培養したウシの胚の生存率を高める。また、ミッドカインは抗菌作用を示し、さらにエイズウィルスの細胞への侵入を抑えることも分かっている。ミッドカインの示す細胞死防止活性、細胞への保護効果はミッドカインを治療薬として使用する観点から注目される。同時に、ミッドカインの保護的作用と、炎症性細胞の移動を促進する作用を個々のケースでどのように分離するかが課題として浮かび上がってきている。
ミッドカインのさらなる活性
ミッドカインは血圧調節、血管新生、骨リモデリング、軟骨形成においても役割を果たす。これらの活性は医学的に重要で、例えばミッドカインは骨破壊を促進するので、ミッドカイン阻害剤が骨粗鬆症の治療に寄与する可能性がある。
ミッドカインの基本的性質
タンパク質
ミッドカインは塩基性タンパク質で、N末端側とC末端側の2つのドメインから主として構成されている。N末端側ドメインに3つのC末端側にドメインに2つのS-S結合が存在する。それぞれのドメインには3本の逆平行β-シートがある(図3)。ミッドカインの活性を担うのは、主として、C末端側のドメインである。ミッドカインはトランスグルタミナーゼの作用を受け二量体を形成する。ミッドカイン活性の中には2量体化が必要なものもある。2量体化にはN-末端側のドメインが重要である。
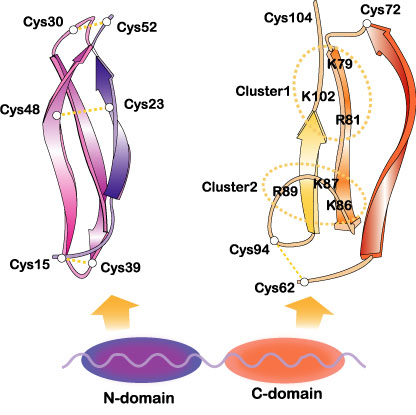
図3
ヒトミッドカインのドメイン構造と各ドメインの立体構造。C-ドメインにある2つのヘパリン結合部位(Cluster 1, Cluster 2)を点線で囲んだ。Muramatsu, T., J. Biochem. 132, 359-371 (2002)およびWiley Encyclopedia Mol. Med. pp2086-2088 (2002) @[・2002, John Wiley & Sons] より許可を得て引用。
ミッドカインと類似したタンパク質としてプレイオトロフィン(略称PTN、別称HB-GAM)が識られている。ミッドカインとプレイオトロフィンは50%のシークエンスが同一である(図4)。
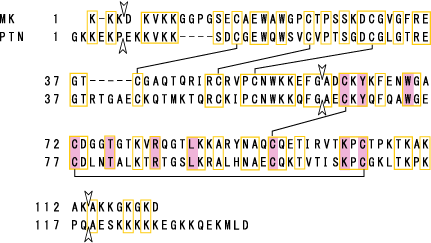
図4
ヒトミッドカイン(MK)のタンパク質構造。プレイオトロフィン(PTN) と比較し、同一のアミノ酸を□で囲んだ。S-S結合は線で結んである。アローヘッド(▼)は遺伝子上のエクソンの境界を示す。シャドーはショウジョウバエのmipleでも保存されているアミノ酸である。Muramatsu, T., J. Biochem., 132, 359-371 (2002)より引用。
ミッドカインはヒトからゼブラフィッシュに到る脊椎動物で見出されている。なお、ゼブラフィッシュでは2種類のミッドカインが存在する。ショウジョウバエにはミッドカインがない。しかし、ミッドカインとプレイオトロフィンの、よりC末端側のドメインに共通した性質を持つmiple およびmiple-2が存在する。
遺伝子
ヒトのミッドカイン遺伝子は染色体の11p 11.2に存在し、その両側にはDGKz(ジアシルグリセロキナーゼゼータ)とCHRM4(ムスカリン性アセチルコリン受容体4)がある(図5)。
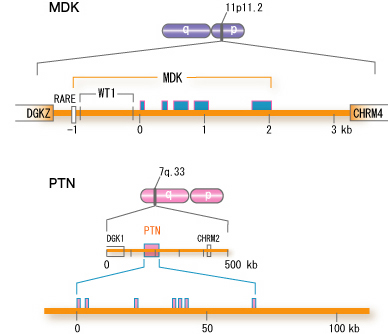
図5
ヒトミッドカイン遺伝子(MDK)の構造。ヒトプレイオフィン遺伝子(PTN)と比較して示した。■はエクソン、RARE、WT1はそれぞれレチノイン酸受容体とWT1の結合部位である。なお最初のエクソンにはこれ以外に2つの亜型があるが図には示していない。Muramatsu, T., J. Biochem. 132, 359-371 (2002)より引用。
ヒトのミッドカイン遺伝子の略号はMDKである。マウスのミッドカイン遺伝子は第2染色体に存在し、その略号はMdkである。ミッドカイン遺伝子の上流にはレチノイン酸応答性エレメント(RARE)があり、ミッドカイン遺伝子の発現はレチノイン酸によって誘導される。また、ウィルムス腫瘍のがん抑制遺伝子WT1の産物の結合部位がある。ウィルムス腫瘍発症の時WT1が欠失すると、抑制が解かれミッドカインの発現が誘導されると考えられる。プレイオトロフィン遺伝子は染色体上のより広い領域に存在するが、基本構成はミッドカイン遺伝子と類似している。
機能と作用機構
ミッドカインが最も強く発現されているのは中期胚である。その中で上皮間葉相互作用をしている上皮組織、分化中の神経組織、そしてリモデリング中の間充織が目立った発現部位である。成体ではミッドカインの発現部位は限られている。血管内皮、特定の粘膜上皮は重要な発現部位である。組織が損害を受けるとミッドカインの発現は増大、あるいは新たに誘導される。ミッドカインは細胞の生存、移動を促進し、さらにこれ以外の種々な活性を持つ(表1)。血管平滑筋細胞を含むゲルの上に、血管内皮細胞を重層した血管モデルを用いて、ミッドカインが上皮と間葉の相互作用に関与する状況が解明されてきた(図6)。
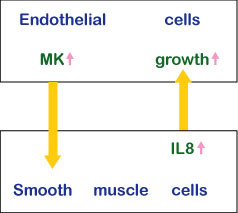
図6
上皮間葉相互作用におけるミッドカイン(MK)の作用様式。
ミッドカインの受容体として最も良く研究されているのは受容体型タンパク質チロシンホスファターゼz (PTPz)である。ミッドカインはこのタンパク質のコンドロイチン硫酸鎖と強い親和性で、そしてタンパク質と弱い親和性で結合する。この他にミッドカイン受容体としてlow density lipoprotein receptor-related protein (LRP)とanaplastic leukemia kinase (ALK)が同定されている(図7)。ヘパラン硫酸プロテオグリカンであるシンデカンもシグナル受容に関与する可能性がある。インテグリンそしてNotch-2も受容体として働くことが発見された。ミッドカイン受容体はこれらの分子が会合した複合体であり、ミッドカイン結合により複合体形成が促進されると考えられている(図8)。下流のシグナルはPI3キナーゼからERKに続く。srcとパキシリンが関与する可能性も強い。
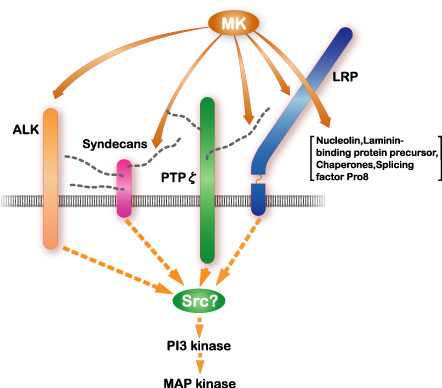
図7
ミッドカイン(MK)のシグナル受容体複合体と下流のシグナル系。Muramatsu, T., J. Biochem., 132, 359-371 (2002)より引用。
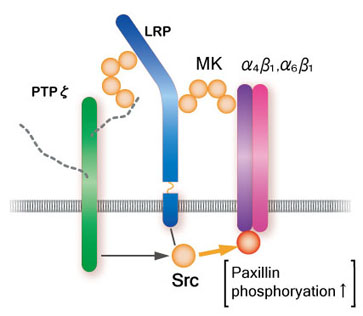
図8
細胞移動促進の時のミッドカイン受容体複合体モデル。
ミッドカインはコンドロイチン硫酸、あるいはヘパラン硫酸の過硫酸化された部分に強く結合する。その構造は図9のようである。
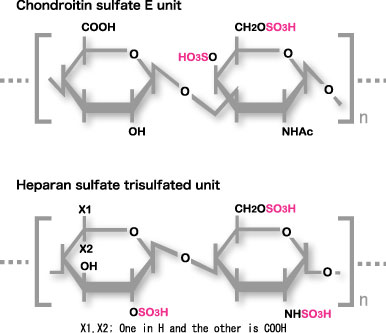
図9
ミッドカインとの強い結合に必要な糖鎖構造。ヘパラン硫酸中のトリ硫酸構造とコンドロイチン硫酸E構造が示してある。
また、ミッドカインは細胞にとりこまれ、さらに核へ移行することが判明した。細胞の生存維持活性には、核移行が必要である。この時、細胞内への取り込みにはLRPが、そして核の移行にはヌクレオリンあるいはラミニン結合タンパク質前駆体が関与しいる。
プレイオトトフィンとミッドカインの関係
プレイオトロフィン(PTN)はミッドカインと50%近いアミノ酸配列同一性を示し、この二つが同一のファミリーを形成することは疑いない。ショウジョウバエでは両者と類似のホモロジーを示す分子が存在し、mipleと呼ばれている。ミッドカイン・プレイオトロフィンファミリーはmiple ファミリーと呼ぶのが適当かもしれない。ミッドカインあるいはプレイオトロフィンのいずれかの遺伝子のみを欠くノックアウトマウスは生理的条件下では比較的軽い異常を示すだけであるが、両者をともに欠くダブルノックアウトマウスは重篤な欠陥を示す。生まれにくさ、低体重(図10)、雌の生殖能力の著しい低下、高度な難聴などである。このことから分かるように、ミッドカインとプレイオトロフィンはしばしば重複した役割を果たしているに違いない。実際、プレイオトロフィンは神経細胞の移動、生存、神経突起の伸張を促進するなど、ミッドカインと同様なin vitro活性を示している。
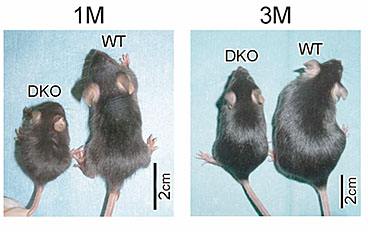
図10
ミッドカイン、プレイオトロフィンダブルノックアウトマウス(DKO)は野生型マウス(WT)に比べて、1ヶ月(1M)、3ヶ月(3M)いずれでも小さい。 Muramatsu H. et al., Genes Cells, 11, 1405-1417 (2006)
しかし、ミッドカインとプレイオトロフィンはそれぞれサカナからヒトにいたるまで、独自の分子として進化的に保存されてきた。このことは、mipleファミリーの2つの分子は生体内で役割を分担していることを強く示唆している。実際、ヒトES細胞の増殖促進活性はこれまでプレイオトロフィンでのみ報告されている。また、プレイオトロフィンは神経幹細胞の分化を促進するが、ミッドカインは同じ細胞の増殖と生存を促進する。発現位置の違いも重要である。両分子ともにシナプス部位においてアセチルコリン受容体のクラスター化を促進するが、プレイオトロフィンは筋肉に発現し、筋肉側の因子、ミッドカインは神経に発現し、神経側の因子と考えられる。
2つの分子は、いずれも、がんで発現が亢進する。しかし、ミッドカインの発現上昇が幅広いがんで認められるのにたいして、プレイオトロフィンの発現上昇はより限られている。とはいえ、ミエローマとメラノーマにおける発現上昇はプレイオトロフィンでのみ報告されている。興味深いことにミッドカインを強く発現するニューロブラストーマの患者の予後は悪いが、プレイオトロフィンを強く発現する場合は予後が良い。
さらに情報を得るには
総説などを読むことによって、より詳しい情報を得られる。以下のものが推薦される。
1. Muramatsu, T. (2002) Midkine and pleiotrophin: two related proteins involved in development, survival, inflammation and tumorigenesis. J. Biochem 132, 359-371.
[https://www.jstage.jst.go.jp/.../132/3/132_3_359/_article]
2. Muramatsu, T. (2002) Midkine in Wiley Encyclopedia of Molecular Medicine pp2086-2088. John Wiley & Sons., Inc. New York, USA.
3. Muramatsu, T. Chondroitin sulfate E in signaling of the growth factor midkine. 成長因子ミッドカインのシグナリングにおけるコンドロイチン硫酸Eの役割
[http://www.glycoforum.gr.jp/science/glycogenes/09/09E.html]
4. Kurtz, A., Schulte, A. M., and Wellstein, A. (1995) Pleiotrophin and midkine in normal development and tumor biology. Crit. Rev. Oncol. 6, 151-177.
5.村松 喬 (2002) ミッドカインの機能と医学的意義。蛋白質核酵素。 47, 1259-1267
6. Locus link (http://www.ncbi.nlm.nih.gov/LocusLink/LocRpt.cgi?l=4192)
7. Kadomatsu, K., and Muramatsu, T. (2004) Midkine and pleiotrophin in neural development and cancer. Cancer Lett. 204, 127-143.
8. Muramatsu T, Muramatsu H, Kaneda N, Sugahara K. (2003) Recognition of glycosaminoglycans by midkine. Methods Enzymol. 363, 365-376.
9. ミッドカイン研究についての管理者の回想
10. Muramatsu, T. (2010) Midkine, a heparin-binding cytokine with multiple roles in development, repair and diseases. Proc. Japan Acad. Ser. B 86, 410-425.[https://www.jstage.jst.go.jp/article/pjab/86/4/86_4_410/_article]
11. Muramatsu, T.(2011) Midkine: A promising molecule for drug development to treat diseases of the central nervous system. Curr. Pharm. Des. 17, 410-423. (ミッドカイン関連の創薬について具体的に書かれている) [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3267162/?tool=pubmed]
12. Erguven, M., Muramatsu, T. and Bilir, A. Eds,. (2012) Midkine: From Embryogenesis to Pathogenesis and Therapy, Springer.(http://www.springer.com/biomed/book/978-94-007-4233-8)
13. British Journal of Pharmacology, midkine special issue (Vol 171, issue 4, 811-1067, 2014) (ミッドカインについての多くの優れた総説が集められている)
このホームページに採録された、参考になる原著論文を読むのも良い。また、Pub Med [http://www.ncbi.nlm.nih.gov/PubMed/] をmidkineで検索することによってさらに多くの論文にアクセスできる。なお、参考になる原著論文の末尾にPMIDが記してある。Pub Med でこの番号を入力すればその論文が出てきて、要旨を読むことができる。


 English
English Japanese
Japanese